合作客戶/
拜耳公司 |
同濟(jì)大學(xué) |
聯(lián)合大學(xué) |
美國(guó)保潔 |
美國(guó)強(qiáng)生 |
瑞士羅氏 |
相關(guān)新聞Info
-
> 基于表面張力測(cè)試優(yōu)化畫筆顏料配方
> 寶寶出生的越早,肺表面活性物質(zhì)越少,肺泡缺乏表面張力
> 流平劑作用原理、種類、應(yīng)用性能及與表面張力的關(guān)系
> 界面張力作用下?泥質(zhì)鉆渣泥化黏附機(jī)理分析
> GA、WPI和T80復(fù)合乳液體系的脂肪消化動(dòng)力學(xué)曲線、界面張力變化(二)
> 基于微量天平測(cè)定人血白蛋白辛酸鈉含量
> 干濕循環(huán)試驗(yàn):不同表面張力下土壤裂隙的發(fā)展演化機(jī)理(一)
> 水與瓦斯煤之間的表面張力計(jì)算方法及動(dòng)態(tài)潤(rùn)濕機(jī)理研究(三)
> 勝利油田常規(guī)和親油性石油磺酸鹽組成、色譜、質(zhì)譜、界面張力測(cè)定(一)
> 表面張力估算法測(cè)定29種常見(jiàn)低芳淺色礦物油的溶解度參數(shù)——實(shí)驗(yàn)部分
推薦新聞Info
-
> 反離子鹽KBr濃度對(duì)酰胺基陽(yáng)離子Gemini表面活性劑的表/界面活性的影響(二)
> 反離子鹽KBr濃度對(duì)酰胺基陽(yáng)離子Gemini表面活性劑的表/界面活性的影響(一)
> 典型離子型與非離子型起泡劑的界面行為對(duì)泡沫性能的影響機(jī)制
> 新無(wú)氰白銅錫電鍍液及電鍍方法可降低表面張力,促進(jìn)鍍液對(duì)復(fù)雜工件的潤(rùn)濕
> 一種耐超高溫酸液體系、制備方法及其應(yīng)用
> 納米滲吸驅(qū)油劑種類、降低界面張力和改變潤(rùn)濕性的能力等機(jī)理研究(四)
> 復(fù)合驅(qū)中聚合物與陰離子表面活性劑的協(xié)同作用研究
> 化學(xué)組成對(duì)無(wú)堿鋁硼硅OLED基板玻璃表面張力的影響——結(jié)果、結(jié)論
> 化學(xué)組成對(duì)無(wú)堿鋁硼硅OLED基板玻璃表面張力的影響——摘要、實(shí)驗(yàn)方法
> 納米滲吸驅(qū)油劑種類、降低界面張力和改變潤(rùn)濕性的能力等機(jī)理研究(三)
應(yīng)用熒光顯微鏡研究了蛋白質(zhì)在氣-水界面的組裝——結(jié)果和討論
來(lái)源:上海謂載 瀏覽 2164 次 發(fā)布時(shí)間:2021-12-14
3.結(jié)果和討論
通過(guò)CD光譜(圓二色光譜和支持信息中的圖S3)和表面壓力測(cè)量(圖S4)對(duì)HSA-TR和野生型HSA進(jìn)行比較表明,染料標(biāo)記僅輕微干擾HSA的二級(jí)結(jié)構(gòu)和疏水性。通過(guò)Langmuir-Schaefer技術(shù)和AFM,我們證明了在AWI處形成的蛋白質(zhì)膜可轉(zhuǎn)移到云母表面,并且類似于一層蛋白質(zhì)層厚(~3 nm)用于HSA-TR和HSA(圖S5)。這與先前的中子反射率研究(建議為單層)非常一致。16因此,最小標(biāo)記、接近天然的HSA為通過(guò)熒光顯微鏡研究AWI組裝提供了有用的模型蛋白質(zhì)樣品。
在圖1中,HSA-TR溶解在PBS中(離子強(qiáng)度=193 mM),并在前面所述的小室裝置中成像(圖1A)。當(dāng)HSA-TR([HSATR])的濃度大于或等于0.050 mg/mL時(shí),通過(guò)共聚焦顯微鏡觀察到均勻的熒光層,如圖1B所示。光學(xué)分辨率為~0.2μm,4倍變焦圖像(圖1C)顯示界面層沒(méi)有特殊結(jié)構(gòu)。然而,當(dāng)[HSA-TR]小于或等于0.025 mg/mL時(shí),在界面處觀察到高度不均勻結(jié)構(gòu),如圖1D所示。放大圖像(圖1E)顯示HSA-TR組裝成微米大小的分形結(jié)構(gòu)。XZ平面圖像進(jìn)一步證實(shí)了不同的結(jié)構(gòu),圖1F中觀察到厚度均勻的熒光層,而圖1G中觀察到不連續(xù)的熒光層。我們的結(jié)果表明,在PBS中離子強(qiáng)度為193mm的條件下,表面飽和體積溶液濃度(CB sat)在0.025和0.050 mg/mL之間。在CB sat以下,吸附的蛋白質(zhì)不能完全覆蓋AWI,因此允許在界面處形成蛋白質(zhì)結(jié)構(gòu)域。以前使用張力測(cè)定法和橢偏法的報(bào)告發(fā)現(xiàn),覆蓋AWI的BSA臨界濃度在10-2和10-1 mg/mL之間,13這與我們的結(jié)果非常吻合。
盡管蛋白質(zhì)吸附領(lǐng)域的研究人員普遍接受CB sat的概念,13,34但很少有研究揭示了濃度低于WCB sat的組裝蛋白質(zhì)的微觀結(jié)構(gòu)。Powers等人報(bào)告了在AWI上觀察到由兩親性肽形成的相結(jié)構(gòu)域。23 Lee等人最近利用微流變學(xué)進(jìn)行的一項(xiàng)研究表明,在相對(duì)較低的濃度下,AWI的β-乳球蛋白層中存在機(jī)械不均一性。在我們之前的研究中,在用俄勒岡州綠標(biāo)記的人纖維蛋白原的AWI處也觀察到不連續(xù)的熒光層,如果蛋白質(zhì)在類似的緩沖條件下以0.01 mg/mL溶解。30早期基于2D晶格的模擬預(yù)測(cè),在低濃度下,可通過(guò)擴(kuò)散限制聚集形成分形網(wǎng)絡(luò)。36 AWI處的XY平面圖像(圖1E)證實(shí)了在低亞相濃度下AWI處存在分形組裝和AWI處的異質(zhì)蛋白質(zhì)層。
然后,我們改變?nèi)芤旱碾x子強(qiáng)度和氧化還原狀態(tài),并監(jiān)測(cè)AWI形成的蛋白質(zhì)組裝體。在將溶液移液到腔室后,在成像之前將界面老化1小時(shí)。PBS中0.010 mg/mL HSA-TR(離子強(qiáng)度=53 mM)的樣品在界面不同位置顯示出分形組裝(圖2A)和相互連接的“瑞士干酪”結(jié)構(gòu)(圖2B)。XY平面圖像的Z疊層顯示了相同條件下界面蛋白質(zhì)層的高分辨率3D圖像(圖2C)。3D圖像是尺寸為45.0*45.0μm2的多個(gè)XY平面圖像的疊加,這些圖像沿AWI上方和下方的Z軸采集,每個(gè)方向10μm(200*0.1μm步長(zhǎng))。這證實(shí)了界面處的“瑞士奶酪”結(jié)構(gòu),并且?guī)缀鯖](méi)有顯示來(lái)自亞相的熒光信號(hào)。雖然沿Z軸的光學(xué)分辨率是~2μm對(duì)于共焦圖像,其比估計(jì)的蛋白質(zhì)層厚度(30-40?)大得多,Z-stack圖像清楚地表明蛋白質(zhì)結(jié)構(gòu)域僅在AWI處形成,并且與在XY平面形成的結(jié)構(gòu)域(數(shù)百微米)相比,Z方向上的組裝受到限制。
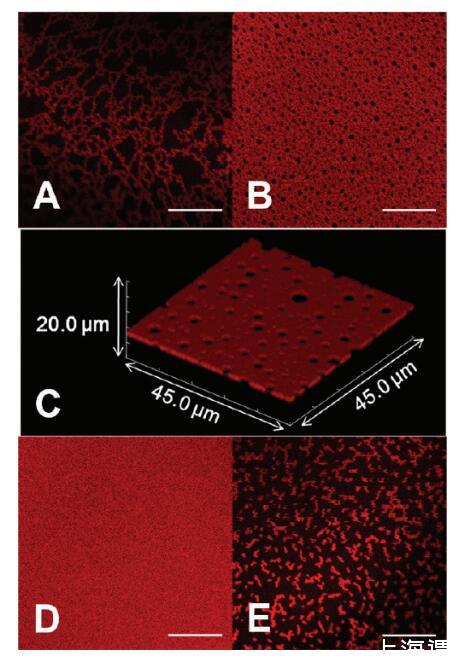
圖2。蛋白質(zhì)組裝的形態(tài),隨離子強(qiáng)度和還原劑的添加而變化。HSATR(0.01 mg/mL)在(A,B)PBS中的AWI下自組裝,pH值7.2,離子強(qiáng)度=53 mM和(C)在掃描體積為45.0*45.0*20.0μm3的情況下,呈現(xiàn)了與圖像B相同的溶液條件對(duì)應(yīng)的共焦圖像Z疊層。(D)PBS,pH值7.2,離子強(qiáng)度=530 mM。(E)30 mM DTT,pH 7.2,離子強(qiáng)度=53 mM的PBS。比例尺:20μm。
在保持蛋白質(zhì)濃度不變的情況下,我們將緩沖液的離子強(qiáng)度增加到530mm。老化1小時(shí)后,我們觀察到均勻熒光層(圖2D),表明表面過(guò)剩增加,平衡時(shí)間縮短。在緩沖液中含有30mmDTT(圖2E)的樣品中,觀察到小的分形結(jié)構(gòu),表明吸附蛋白質(zhì)之間的相互作用較弱。我們還研究了HSA-TR在高離子強(qiáng)度(530mm)的PBS中溶解時(shí)界面層形成的動(dòng)力學(xué)。觀察到從密集分形(圖3A)到瑞士奶酪結(jié)構(gòu)(圖3B)以及最終到均勻熒光層(圖3C)的明顯轉(zhuǎn)變。在大約30分鐘內(nèi),AWI達(dá)到平衡,形成均勻的熒光層。Dhar等人最近的一項(xiàng)研究發(fā)現(xiàn),隨著時(shí)間的推移,BSA層的表面粘度急劇增加,并推斷出組織結(jié)構(gòu)發(fā)生了變化。37我們的研究直接顯示了從分形到均勻組織層的形態(tài)轉(zhuǎn)變,這可以解釋觀察到的抗剪切性增加。

圖3。顯示異質(zhì)結(jié)構(gòu)域轉(zhuǎn)變?yōu)橥|(zhì)層的熒光圖像。C(HSA-TR)=PBS中的0.01 mg/mL,pH值7.2,離子強(qiáng)度=530 mM。(A)3、(B)8和(C)將蛋白質(zhì)溶液引入試驗(yàn)箱后36分鐘。標(biāo)尺:50μm。
我們的結(jié)果表明,溶液條件可以調(diào)節(jié)蛋白質(zhì)自組裝的結(jié)構(gòu)。HSA的等電點(diǎn)約為4.7。24因此,在pH值為7.2時(shí),HSA-TR帶負(fù)電。靜電排斥強(qiáng)烈影響HSA-TR在AWI處的聚集,導(dǎo)致低包裝效率,如圖2A,B所示。分形結(jié)構(gòu)和瑞士干酪結(jié)構(gòu)共存表明非平衡狀態(tài),這是由于蛋白質(zhì)從亞相的緩慢吸附受到界面上已經(jīng)存在的帶電蛋白質(zhì)的排斥力的阻礙。在較高的離子強(qiáng)度下,帶電蛋白質(zhì)分子之間的靜電斥力被更有效地屏蔽,HSA-TR吸附到界面的速度更快,并且能夠更緊密地堆積,從而形成更均勻的層。如圖2D和3C所示,AWI的完全覆蓋率低于CB sat。在較低的離子強(qiáng)度(193 mM)下,在吸附時(shí)間1 h后,測(cè)定CB sat在0.025和0.050 mg/mL之間的值。在較高的離子強(qiáng)度(530mm)下,由于被吸附的蛋白質(zhì)和來(lái)自塊體的蛋白質(zhì)之間的排斥作用較小,因此塊體溶液蛋白質(zhì)對(duì)AWI的吸附更快。此外,蛋白質(zhì)分子在界面上的堆積效率更高,從而實(shí)現(xiàn)了更高的蛋白質(zhì)覆蓋率。
據(jù)報(bào)道,吸附在AWI上的蛋白質(zhì)可以形成分子間二硫鍵,從而穩(wěn)定蛋白質(zhì)網(wǎng)絡(luò)并增強(qiáng)吸附層的彈性。38 HSA有一個(gè)反應(yīng)性半胱氨酸,Cys34,可在AWI處與相鄰蛋白質(zhì)形成二硫鍵。此外,吸附后構(gòu)象的變化可能導(dǎo)致分子內(nèi)二硫鍵的斷裂,為分子間二硫鍵的形成提供更多的反應(yīng)位點(diǎn)。DTT等還原劑抑制分子間二硫鍵的形成,因此只剩下小聚集體,這些聚集體可能通過(guò)疏水相互作用結(jié)合在一起。Vogler等人應(yīng)用界面流變學(xué)來(lái)研究AWI處的HSA,并發(fā)現(xiàn)吸附層既具有粘性又具有彈性。28二硫鍵的形成支持彈性來(lái)自分子間相互作用網(wǎng)絡(luò)的假設(shè)。有趣的是,利用BSA進(jìn)行的微流變學(xué)研究發(fā)現(xiàn),蛋白質(zhì)膜主要是粘性的,沒(méi)有形成強(qiáng)的分子間鍵。37因此,AWI處蛋白質(zhì)二硫鍵的作用可能在不同的蛋白質(zhì)系統(tǒng)中有很大差異。
最后,將FDA批準(zhǔn)的表面活性劑F-127添加到HSA-TR溶液中,以改變AWI處吸附物種之間的疏水相互作用。疏水相互作用導(dǎo)致蛋白質(zhì)中疏水單元的組裝或聚集,從而降低溶劑化能。39在蛋白質(zhì)組裝中,多個(gè)蛋白質(zhì)分子的疏水斑塊傾向于聚集在一起,將水從其表面排除,從而增加系統(tǒng)的熵。40當(dāng)添加更疏水的表面活性劑時(shí),它與蛋白質(zhì)-蛋白質(zhì)疏水相互作用競(jìng)爭(zhēng)。已知表面活性劑在AWI處與蛋白質(zhì)相互作用,顯著降低表面張力并改變表面層的流變行為。41如Morris等人先前AFM研究中的“造山”模型所述,表面活性劑以非均勻方式從AWI置換蛋白質(zhì)。19然而,只有BAM研究18提供了現(xiàn)場(chǎng)測(cè)量的直接證據(jù),動(dòng)態(tài)轉(zhuǎn)變的各個(gè)方面仍然未得到充分探索。
通過(guò)我們的原位熒光顯微鏡方法,我們?cè)贖SA-TR/F-127混合物的AWI處發(fā)現(xiàn)了熒光強(qiáng)度較強(qiáng)和較弱的區(qū)域,表明發(fā)生了相分離。蛋白質(zhì)在AWI處形成粘彈性網(wǎng)絡(luò),導(dǎo)致蛋白質(zhì)的分子遷移率比蛋白質(zhì)-表面活性劑混合物的分子遷移率小2個(gè)數(shù)量級(jí)。41因此,我們預(yù)計(jì)富含蛋白質(zhì)區(qū)域的熒光恢復(fù)速度應(yīng)比表面活性區(qū)域慢得多。為了驗(yàn)證這一假設(shè),我們進(jìn)行了FRAP實(shí)驗(yàn),用HSA-TR/F-127溶液(HSA-TR為0.10 mg/mL)和F-127溶液(HSA-TR為0.0050 mg/mL)評(píng)估界面層的流動(dòng)性。用近紫外激光束同時(shí)漂白強(qiáng)熒光和弱熒光區(qū)域的兩個(gè)圓形區(qū)域20 s。在之前和之后拍攝圖像使用衰減的543nm激光作為激發(fā)源進(jìn)行漂白。照射90秒后,左上方的漂白區(qū)變小,25分鐘后,強(qiáng)度幾乎完全恢復(fù);然而,右下方的漂白區(qū)域并未隨時(shí)間改變形狀或強(qiáng)度(圖4)。因此,我們得出結(jié)論,強(qiáng)度恢復(fù)率的巨大差異表明界面上“富含蛋白質(zhì)”和“富含表面活性劑”區(qū)域的分離。熒光強(qiáng)度較強(qiáng)的區(qū)域主要由HSA-TR組成,熒光強(qiáng)度較弱的區(qū)域主要由HSA-TR與F-127混合組成。表面活性劑富集區(qū)的蛋白質(zhì)被表面活性劑分子分離,更容易擴(kuò)散,使得HSA-TR的橫向遷移率遠(yuǎn)高于蛋白質(zhì)富集區(qū)。然而,熒光恢復(fù)期間漂白區(qū)形狀的變化表明,富含表面活性劑的區(qū)域中的質(zhì)量傳輸不均勻。結(jié)合多種擴(kuò)散過(guò)程的適當(dāng)分析方法,F(xiàn)RAP實(shí)驗(yàn)有可能確定AWI處蛋白質(zhì)分子擴(kuò)散系數(shù)的分布。

圖4。界面層光漂白后的熒光恢復(fù)。ROI(黃色圓圈)是選定的光漂白區(qū)域。ROI-1位于富含表面活性劑的區(qū)域,而ROI-2位于富含HSA TR的區(qū)域。初始亞相濃度為[HSA-TR]=0.10 mg/mL和[F-127]=0.0050 mg/mL。比例尺:20μm。
我們發(fā)現(xiàn)在HSA-TR/F-127混合物中,蛋白里奇區(qū)表現(xiàn)出隨時(shí)間變化的形態(tài)變化,這促使我們更詳細(xì)地研究這一動(dòng)態(tài)現(xiàn)象。圖5所示的結(jié)果是通過(guò)將HSA-TR(0.50 mg/mL)與F-127(0.015 mg/mL)混合,聚焦在AWI上拍攝的圖像。圖5A顯示了將溶液用移液管移入腔室后35至60分鐘內(nèi)聚焦在同一區(qū)域的三幅圖像。可見(jiàn)面積為10-100μm2的小圓形蛋白質(zhì)島。感興趣區(qū)域(ROI,由圖5中的黃色方框表示)突出顯示了一些有趣的觀察結(jié)果:在ROI-1中,與35分鐘時(shí)的圖像相比,小的蛋白質(zhì)島在50分鐘時(shí)與周圍的蛋白質(zhì)島結(jié)合形成一個(gè)更大的島。在ROI-2中,從50分鐘開(kāi)始可以看到小黑洞,表明F-127在這些位點(diǎn)取代了HSA-TR,并在富含蛋白質(zhì)的區(qū)域內(nèi)形成空腔。在ROI-3中,可以觀察到表面活性劑富集區(qū)前沿的移動(dòng)。很明顯,隨著時(shí)間的推移,表面活性劑富集區(qū)不斷擴(kuò)大。在ROI-4中,小的蛋白質(zhì)島合并成網(wǎng)狀網(wǎng)絡(luò)。
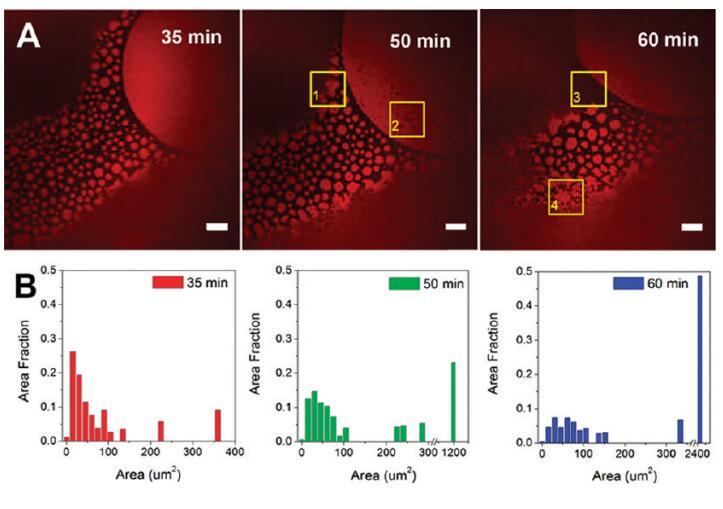
圖5。蛋白質(zhì)島隨時(shí)間的聚合。(A)導(dǎo)入后35、50和60分鐘拍攝的共焦熒光圖像。比例尺:20μm.(B)蛋白質(zhì)島大小分布的直方圖。初始亞期濃度為[HSA-TR]=0.50 mg/mL和[F-127]=0.015 mg/mL。ROI-1表示一個(gè)區(qū)域(黃色框),其中小的蛋白質(zhì)島與周圍的蛋白質(zhì)島結(jié)合形成一個(gè)較大的島;ROI-2表明該區(qū)域形成了小黑洞;ROI-3表示在表面活性劑富集區(qū)域的邊界處的運(yùn)動(dòng);ROI-4顯示了小的蛋白質(zhì)島合并成網(wǎng)狀網(wǎng)絡(luò)的地方。
我們使用ImageJ分析了蛋白質(zhì)島的大小分布(圖5B)。31面積分?jǐn)?shù)定義為相同大小的蛋白質(zhì)島的表面積除以蛋白質(zhì)島總面積的總和。圖5B顯示了島嶼規(guī)模分布的明顯增長(zhǎng)趨勢(shì)。蛋白質(zhì)島的平均面積從24μm2(35分鐘)增加到57μm2(60分鐘)。通過(guò)使用30幀/秒的更快掃描速率(支持信息中的電影S1,其中電影中的圖像顯示速度比實(shí)時(shí)慢10倍)也觀察到蛋白質(zhì)島的運(yùn)動(dòng),并且觀察到蛋白質(zhì)島表現(xiàn)出類似于單層脂質(zhì)結(jié)構(gòu)域布朗運(yùn)動(dòng)的運(yùn)動(dòng)。42重要的是,觀察到鄰近島嶼在接觸時(shí)結(jié)合在一起。富含蛋白質(zhì)的結(jié)構(gòu)域的存在表明蛋白質(zhì)和表面活性劑在動(dòng)力學(xué)過(guò)程中共同吸附到界面。蛋白質(zhì)分子之間的強(qiáng)相互作用促進(jìn)了結(jié)構(gòu)域的形成和結(jié)構(gòu)域的合并,從而阻止了表面活性劑的置換。然而,F(xiàn)-127的界面占有率在熱力學(xué)上是有利的,其中F-127在0.015 mg/mL時(shí)的平衡表面張力約為40 mN/m43,而HSA在0.50 mg/mL時(shí)的平衡表面張力為52-60 mN/m。34因此,隨著時(shí)間的推移,蛋白質(zhì)結(jié)構(gòu)域逐漸被表面活性劑從本體中置換,以降低表面能。
表面活性劑穿透蛋白質(zhì)結(jié)構(gòu)域的觀察和表面活性劑富集區(qū)的擴(kuò)展符合造山模型。該模型表明,表面活性劑首先穿透蛋白質(zhì)層,形成缺陷或孔洞,從而取代界面上的蛋白質(zhì)。然后,隨著表面活性劑繼續(xù)在這些區(qū)域累積,表面活性劑區(qū)域擴(kuò)張,蛋白質(zhì)層被迫彎曲并延伸到亞相,直到蛋白質(zhì)層最終坍塌。1,19在肺表面活性物質(zhì)/聚乙二醇/白蛋白混合物中顯示了不同的置換機(jī)制,這表明競(jìng)爭(zhēng)吸附過(guò)程可能依賴于系統(tǒng)。在表面張力和表面流變學(xué)研究中,44個(gè)理論模型已被開(kāi)發(fā)用于解釋蛋白質(zhì)/表面活性劑混合溶液的吸附動(dòng)力學(xué)和平衡狀態(tài)。41作為對(duì)這些研究的補(bǔ)充,我們的工作提供了關(guān)于蛋白質(zhì)和表面活性劑在界面上的位置以及組裝結(jié)構(gòu)的更詳細(xì)信息。在我們的研究中觀察到的聚結(jié)現(xiàn)象表明,相鄰的蛋白質(zhì)結(jié)構(gòu)域有重組連接網(wǎng)絡(luò)的趨勢(shì),而其他蛋白質(zhì)正被表面活性劑取代,因此突出了HSA-TR/F-127混合物中蛋白質(zhì)結(jié)構(gòu)域聚結(jié)和表面活性劑取代蛋白質(zhì)的兩個(gè)競(jìng)爭(zhēng)過(guò)程。
應(yīng)用熒光顯微鏡研究了蛋白質(zhì)在氣-水界面的組裝——摘要、介紹
應(yīng)用熒光顯微鏡研究了蛋白質(zhì)在氣-水界面的組裝——材料和方法
應(yīng)用熒光顯微鏡研究了蛋白質(zhì)在氣-水界面的組裝——結(jié)果和討論
應(yīng)用熒光顯微鏡研究了蛋白質(zhì)在氣-水界面的組裝——結(jié)論、致謝!










